Системно-биологический подход к анализу фармакологических эффектов постулирует реализацию фармакологического действия лекарств (в т.ч. на основе микроэлементов) как результата весьма сложных взаимодействий исследуемого агента с геномом, транскриптомом, протеомом и реактомом всего организма. Системная биология является естественной антитезой примитивным редукционистским схемам наподобие «одно лекарство — один таргетный белок», «клетка — комок протоплазмы», «мембранный клей» и т.п., которые не только тормозят развитие биомедицины, но и наносят серьезнейший вред миллионам пациентов. В самом деле, фармакологические препараты, разработанные и внедренные на рынок в рамках идеологии редукционизма (т.е. сверхупрощения исследуемых процессов) не могут не иметь обширного количества побочных эффектов (в среднем, 10 побочных эффектов на препарат).
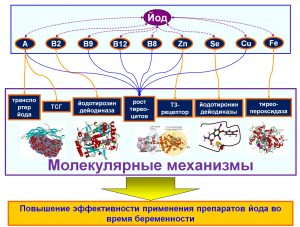
Комплексный подход к оценке фармакологического действия чрезвычайно важен в случае оценки биологического действия микроэлементов. Например, до середины прошлого века считалось, что эндемичные формы патологии щитовидной железы обусловлены исключительно монодефицитом йода. Из этого сверхупрощенного воззрения следовало, что терапия монопрепаратами йода является достаточной и высокоэффективной. Однако, десятки тысяч фундаментальных исследований по биохимии, молекулярной фармакологии микроэлементов показали, что в профилактике и терапии йод–дефицитных состояний у беременных не следует упускать из виду неразрывную связь метаболизма йода с метаболизмом других микроэлементов и микронутриентов.
Без этих микронутриентов-синергистов йода (цинк, селен, медь, железо, витамин А, витамины группы В), монопрепараты йода значительно менее эффективны [1] (Рис. 1). Например, ферменты йодтиронин дейодиназы I–го, II–го и III–го типов катализируют дейодинацию тиреоидного гормона Т4 в трийодтиронин (Т3). Поскольку активные центры этих ферментов содержат селеноцистеин, то дефицит селена приведет к падению активности этих ферментов и усугубит последствия дефицита йода.
Рис. 1. Молекулярные механизмы осуществления эффектов синергистов йода
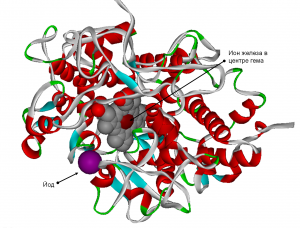
Другой пример: недостаточность железа снижает синтез тиреоидных гормонов путем снижения активности гем-зависимой тиреопероксидазы (Рис. 2), так что железодефицитная анемия снижает эффективность препаратов йода в терапии и профилактике йод-дефицитных заболеваний [1].
Рис. 2. Пространственная структура гем-зависимой тиреопероксидазы (PDB файл 3krq). Показаны гем, содержащий атом железа (темно-красная сфера) и атом йода (фиолетовая сфера), участвующий в катализируемой реакции. При недостаточном потреблении железа активность данного фермента падает, что приводит к нарушению метаболизма йода.
Аналогичная ситуация наблюдается и в случае железодефицитной анемии (ЖДА). Несмотря на свое название, существует целый спектр микронутриентов, необходимых для полноценного усвоения железа организмом, проявления биологических эффектов железа и, следовательно, профилактики ЖДА. К этим микронутриентам относятся, в частности, ионы медь, марганец, цинк и молибен, синергидные с железом на уровне молекулярных маршрутов. Результаты такого анализа дали обоснование для эффективного патогенетического лечения ЖДА и профилактики дефицита железа во время беременности [2].
Системно-биологический подход еще более важен в случае анализа биологических ролей микроэлементов, отличающимся крайне сложным физиологическим воздействием на организм. Например, анализ эффектов лития в масштабе протеома указал на существование 47 белков, активность которых зависит от ионов лития (белки, регулируемые посредством киназы GSK3ß; белки, модулирующие уровень инозитолфосфатов; белки, модулирующие метаболизм нейротрансмиттеров и др.) [3].
- Громова О.А., Торшин И.Ю., Кошелева Н.Г. Молекулярные синергисты йода: новые подходы к эффективной профилактике и терапии йод-дефицитных заболеваний у беременных. РМЖ. Мать и дитя. 2011. Т. 19. № 1. С. 51-58.
- Громова О.А., Торшин И.Ю., Хаджидис А.К. Анализ молекулярных механизмов воздействия железа (ii), меди, марганца в патогенезе железодефицитной анемии. Клиническая фармакология и фармакоэкономика. 2010. Т. 3. № 1. С. 30.
- Торшин И.Ю., Громова О.А., Майорова Л.А., Волков А.Ю. О таргетных белках, участвующих в осуществлении нейропротекторных эффектов цитрата лития. Неврология, нейропсихиатрия, психосоматика. 2017. Т. 9. № 1. С. 78-83.
- Громова О.А., Торшин И.Ю., Тапильская Н.И. Протеомный анализ магний-зависимых белков в системе «мать – плод – ребенок». Медицинский совет. 2017. № 1. С. 66-76.
- Торшин И.Ю., Громова О.А., Сухих Г.Т., Рудаков К.В. Молекулярные механизмы регуляции магнием плацентарных белков. Российский вестник акушера-гинеколога. 2008. Т. 8. № 6. С. 9-16.
- Громова О.А., Торшин И.Ю., Рудаков К.В., Громов А.Н., Калачева А.Г. Систематический анализ магнийзависимых митохондриальных белков. Кардиология. 2014. Т. 54. № 9. С. 86-92.
- Торшин И.Ю., Громова О.А. Молекулярные функции магний-зависимых белков миокарда указывают на перспективы кардиологического применения препаратов на основе оротата магния. Фарматека. 2016. № 9 (322). С. 54-59.
- Громова О.А., Торшин И.Ю., Калачева А.Г., Курамшина Д.Б. Молекулярно-биологические основы нейропротекторных эффектов магния. Журнал неврологии и психиатрии им. C.C. Корсакова. 2011. Т. 111. № 12. С. 90-101.
