Как показывают результаты клинико-эпидемиологических исследований, восполнение дефицитов микроэлементов является важнейшим компонентом профилактики многочисленных хронических патологий. Компенсация микронутриентных дефицитов должна осуществляться такими солями микроэлементов, которые могут обеспечить наибольшую эффективность (т.е. наиболее полное всасывание и накопление соли в организме) и безопасность (т.е. наименьшую токсичность). Наибольшая эффективность усвоения того или иного микроэлемента организмом обеспечивается посредством использования солей, которые: 1) обладают высокой растворимостью, 2) не взаимодействуют с веществами, затрудняющими всасывание катионов микроэлемента, 3) содержат анион, стимулирующий внутриклеточное всасывание катионов микроэлемента. Всем данным условиям удовлетворяют растворимые формы микроэлементов на основе органических солей (фумаратов, цитратов, лактатов, малатов, оротатов и др.) [1].
Сравнительные фармакокинетические исследования препаратов на основе различных солей подтверждают эффективность органических солей. Например, в сравнительном исследовании, включившего 16 добровольцев, оценивалось всасывание различных фармформ (раствора для питья и таблеток) и солей/соединений магния. Препараты на основе органических солей, вне существенной зависимости от формы приёма, статистически достоверно поднимали уровни магния в плазме и в эритроцитах, в то время как препарат сравнения на основе неорганического соединения магния не приводил к статистически значимым различиям в уровнях магния [2].
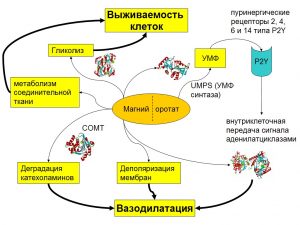
Анионы органических кислот могут проявлять дополнительные свойства, усиливающие биологическое действие микронутриента. Например, оротовая кислота и ее магниевая соль используются в качестве фармакологических препаратов группы анаболиков и в кардиологической практике.В составе органической соли, магний и оротат-анион проявляют синергидные фармакодинамические свойства, чего не происходит в случае неорганических солей магния, в которых анион диссоциирует при попадании соли в раствор [3] (Рис. 1).
Рис. 1. Молекулярные механизмы воздействия магния оротата
Органические соли цинка характеризуются лучшими органолептическим свойствами и легче переносятся детьми, чем более “жесткие” на вкус органические соли. Например, была изучена эффективность применения органических солей цинка в комплексе с молозивом. В течение 60 дней 74 часто болеющих ребенка 4-6 лет получали препарат цинка путем рассасывания (n = 30) или внутрь (n = 18), или не получали препарат (контроль, n = 26) в дополнение к стандартной терапии. В группах детей, принимавших препарат цинка, отмечено значительное улучшение по сравнению с контрольной группой (средние баллы эффективности терапии составили 5,7, 4,7 и 2,7, для трех групп соответственно, p < 0,002 для первой и второй групп); установлена зависимость эффектов от уровня дефицита цинка, существовавшего до начала проведения клинического наблюдения. Так, пациенты с низкими уровнями цинка на момент начала исследования (активность щелочной фосфатазы < 95 ммоль/л) характеризовались низкой эффективностью терапии (2-4 балла). В то же время, терапия пациентов с более высоким уровнем цинка (активность ЩФ 95-110 ммоль/л на момент начала исследования) была более успешной (5-7 баллов, OR = 6,0, 95% CI = 1,0-37,0, p = 0,04). Применение пищевой добавки, содержащей препарат цинка, оказалось эффективным для облегчения симптоматики и сокращения длительности течения ОРИ у часто болеющих детей, без каких либо побочных эффектов и отказов от терапии [4].
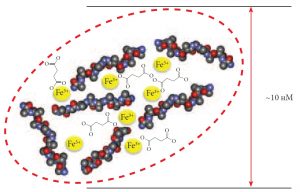
Для профилактики и терапии железодефицитной анемии необходимо использовать эффективные и безопасные препараты железа, а не устаревшие неорганические формы. Анализ безопасности применения различных поколений железо-содержащих препаратов [5] подвтерждает важность использования органических форм железа (таких, как протеин сукцинилат железа, фумарат железа, глюконат железа и др.) [6, 7]. Органические анионы и короткие отрезки пептидов образуют своего рода “защитную оболочку” вокруг ионов железа, что облегчает транспорт железа внутрь клеток (Рис. 2).
Рис. 2. Комплекс ионов железа, сукцинилата и петидных фрагментов казеина в составе протеин сукцинилата железа
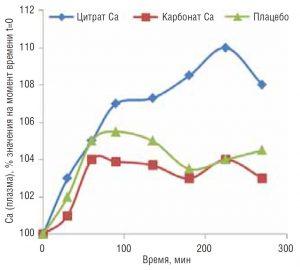
Нарушения минерального обмена, в том числе дефицит кальция, сопровождают «болезни цивилизации» и повышают риск коморбидных состояний. Фармакокинетические параметры препаратов кальция (Са) для приема внутрь существенно зависят от состояния желудочно-кишечного тракта и, прежде всего, от кислотности желудка. Выделяют неорганические (I поколение) и органические (II поколение) препараты Са. Подавляющее большинство препаратов I поколения представлены карбонатом Ca, который нерастворим в воде и требует определенного диапазона кислотности среды (pH) для усвоения. Органические препараты Ca лучше растворяются в воде, существенно меньше зависят от рН желудочного сока и способствуют более эффективному повышению уровней кальция в крови [9] (Рис. 3). Растворимые препараты кальция на основе цитрата и лактата не снижают кислотности желудка и, соответственно, оказывают благоприятное влияние на всасываемость других микронутриентов [10].
Рис. 3. Изменения уровня Са в сыворотке крови при приеме различных его солей (1200 мг элементарного Са)
Органические соли лития также менее токсичны и более эффективны, чем неорганический карбонат лития. Исследование показателей острой токсичности на самцах белых крыс линии Вистар показало, что LD50 аскорбата лития составляет 6,334 г/кг. Субстанция относится к соединениям 5-го класса токсичности, т.е. практически нетоксичным. Коэффициент кумуляции составил 14,8, что свидетельствует о низком кумулятивном эффекте и низкой токсичности. При исследовании хронической токсичности у животных, получавших аскорбат лития ежедневно, в дозах от 1/10 LD50 (630 мг/кг), в течение 30 дней, данные гистологического исследования указывают на то, что происходит функциональное перенапряжение нейроэндокринного аппарата (гетерогенность клеточных элементов, признаки дистрофических изменений в коре головного мозга) и, в меньшей степени, внутренних органов (печени, половых органов, почек) [11]. Напомним, что токсичность карбоната лития на порядок выше – 525 мг/кг. Аскорбат анион в составе аскорбата лития также может проявлять нейрофизиологические, фармакокинетические, гемодинамические, противовоспалительные и др. эффекты, дополняющие действие катиона лития. Например, по сравнению с контрольными молекулами (никотинатом, оксибутиратом, коменатом и карбонатом лития), аскорбат-аниону свойственно большее сродство к серотониновым, дофаминовым, бензодиазепиновым, адренергическим рецепторам. Более высокое, по сравнению с никотинатом, сродство к рецепторам бензодиазепинов человека указывает на возможные анксиолитические эффекты аскорбата. Карбонат анион не обладает ни одним из вышеперечисленных свойств аскорбат-аниона [12].
Литература
- Прокопович О.А., Калачева А.Г., Торшин И.Ю., Громова О.А., Адамян Л.В., Грачева О.Н. Перспективы использования растворимых органических форм магния. Медицинский совет. 2015. № 11. С. 90-97.
- Громова О.А., Волков А.Ю., Глаговский П.Б., Гришина Т.Р., Жидоморов Н.Ю., Калачева А.Г., Мамедов И.С., Назаренко О.А., Ссадин А.В., Сатарина Т.Е., Торшин И.Ю. Динамики концентрации магния в крови после приема различных магнесодержащих препаратов. Фарматека. 2009. № 10. С. 63-68.
- Громова О.А., Торшин И.Ю., Калачева А.Г. Метаболомный компендиум по магния оротату. Эффективная фармакотерапия. 2015. № 44. С. 14-26.
- Громова О.А., Торшин И.Ю., Калачева А.Г., Галицкая С.А., Лиманова О.А., Волков А.Ю., Гришина Т.Р., Федотова Л.Э., Жевнеров А.В. Использование различных способов приема биоусвояемых органических солей цинка с эстрактом молозива у часто и длительно болеющих детей. Педиатрическая фармакология. 2009. Т. 6. № 1. С. 37-42.
- Громова О.А., Торшин И.Ю., Хаджидис А.К. Нежелательные эффекты сульфата железа в акушерской, педиатрической и терапевтической практике. Земский врач. 2010. № 2 (2). С. 39-44.
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К., Гоголева И.В. Систематический анализ фармакологических свойств протеин сукцинилата железа. Эффективная фармакотерапия. 2018. № 13. С. 20-29.
- Назаренко О.А., Громова О.А., Демидов В.И., Торшин И.Ю., Томилова И.К., Алексахина Е.Л. Сравнительная оценка хронической перегрузки железом при применении препаратов железа в субтоксических дозах. Терапия. 2016. № 6 (10). С. 82-88.
- Громова О.А., Торшин И.Ю., Гришина Т.Р., Лисица А.В. Перспективы использования препаратов на основе органических солей кальция. молекулярные механизмы кальция. Лечащий врач. 2013. № 4. С. 42.
- Громова О., Волков А., Торшин И., Громов А., Носиков В., Гоголева И. Сравнительный анализ растворимости различных препаратов кальция в зависимости от кислотности среды. Врач. 2013. № 7. С. 18-24.
- Громова О.А., Торшин И.Ю., Пронин А.В., Егорова Е.Ю., Волков А.Ю. Дифференцированный подход к выбору растворимых кальциевых препаратов второго поколения. Лечащий врач. 2014. № 11. С. 60.
- Остренко К.С., Сардарян И.С., Громова О.А., Колоскова Е.М., Пронин А.В., Торшин И.Ю. Определение острой токсичности и негативного воздействия высоких доз аскорбата лития при длительном применении на крысах линии вистар. Фармакокинетика и фармакодинамика. 2016. № 4. С. 43-54.
- Торшин И.Ю., Сардарян И.С., Громова О.А., Расташанский В.А., Федотова Л.Э. Хемореактомное моделирование эффектов аскорбата, никотината, оксибутирата, комената и карбоната лития. Фармакокинетика и фармакодинамика. 2016. № 3. С. 47-57.
